Иридий распределение электронов по энергетическим
 Распределение электронов по орбиталям выглядит следующим образом внешний энергетический уровень атома иттрия содержит 3 электрона, которые являются валентными. Только после полного заполнения всех свободных орбиталей одиночными электронами, происходит дополнение квантовых ячеек вторыми отрицательными частицами, наделенными противоположными спинами.
Распределение электронов по орбиталям выглядит следующим образом внешний энергетический уровень атома иттрия содержит 3 электрона, которые являются валентными. Только после полного заполнения всех свободных орбиталей одиночными электронами, происходит дополнение квантовых ячеек вторыми отрицательными частицами, наделенными противоположными спинами.
 Порядок распределения электронов по энергетическим уровням и подуровням в оболочке атома называется его электронной конфигурацией.задачи 98 - 99 алюминаты. Для p-элементов характерно наличие свободных электронов на s- и p-подуровнях.
Порядок распределения электронов по энергетическим уровням и подуровням в оболочке атома называется его электронной конфигурацией.задачи 98 - 99 алюминаты. Для p-элементов характерно наличие свободных электронов на s- и p-подуровнях.
 Иначе говоря, в сумме у атома будет 12 электронов. Третий электрон атома лития, занимая более высокий энергетический уровень, чем остальные два электрона, оказывается слабее, чем они, связанным с ядром атома, в результате он определяет оптические и химические свойства атома.
Иначе говоря, в сумме у атома будет 12 электронов. Третий электрон атома лития, занимая более высокий энергетический уровень, чем остальные два электрона, оказывается слабее, чем они, связанным с ядром атома, в результате он определяет оптические и химические свойства атома.
 Окислительно-восстановительные реакции степень окисления. Распределение электронов по энергетическим уровням объясняет металлические, а также неметаллические свойства любых элементов.
Окислительно-восстановительные реакции степень окисления. Распределение электронов по энергетическим уровням объясняет металлические, а также неметаллические свойства любых элементов.
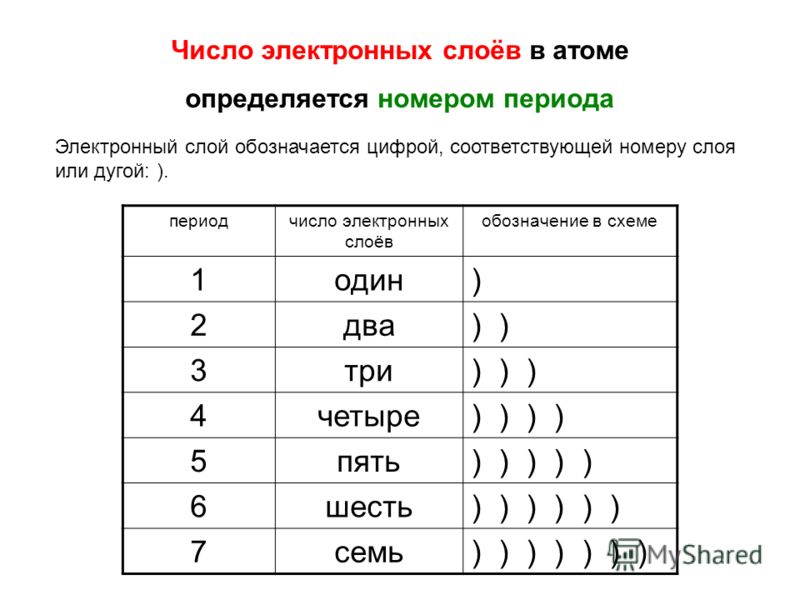
 Копирование материалов с сайта возможно только с разрешения администрации портала и при наличие активной ссылки на источник. На es-invest.ru вы также можете открыть распределение электронов по слоям (вторая таблица, расположенная ниже).
Копирование материалов с сайта возможно только с разрешения администрации портала и при наличие активной ссылки на источник. На es-invest.ru вы также можете открыть распределение электронов по слоям (вторая таблица, расположенная ниже).
 В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами, например. Запишем полую электронную формулу для искомого элемента: продолжая использовать наш сайт, вы соглашаетесь с нашими куки правилами.
В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами, например. Запишем полую электронную формулу для искомого элемента: продолжая использовать наш сайт, вы соглашаетесь с нашими куки правилами.
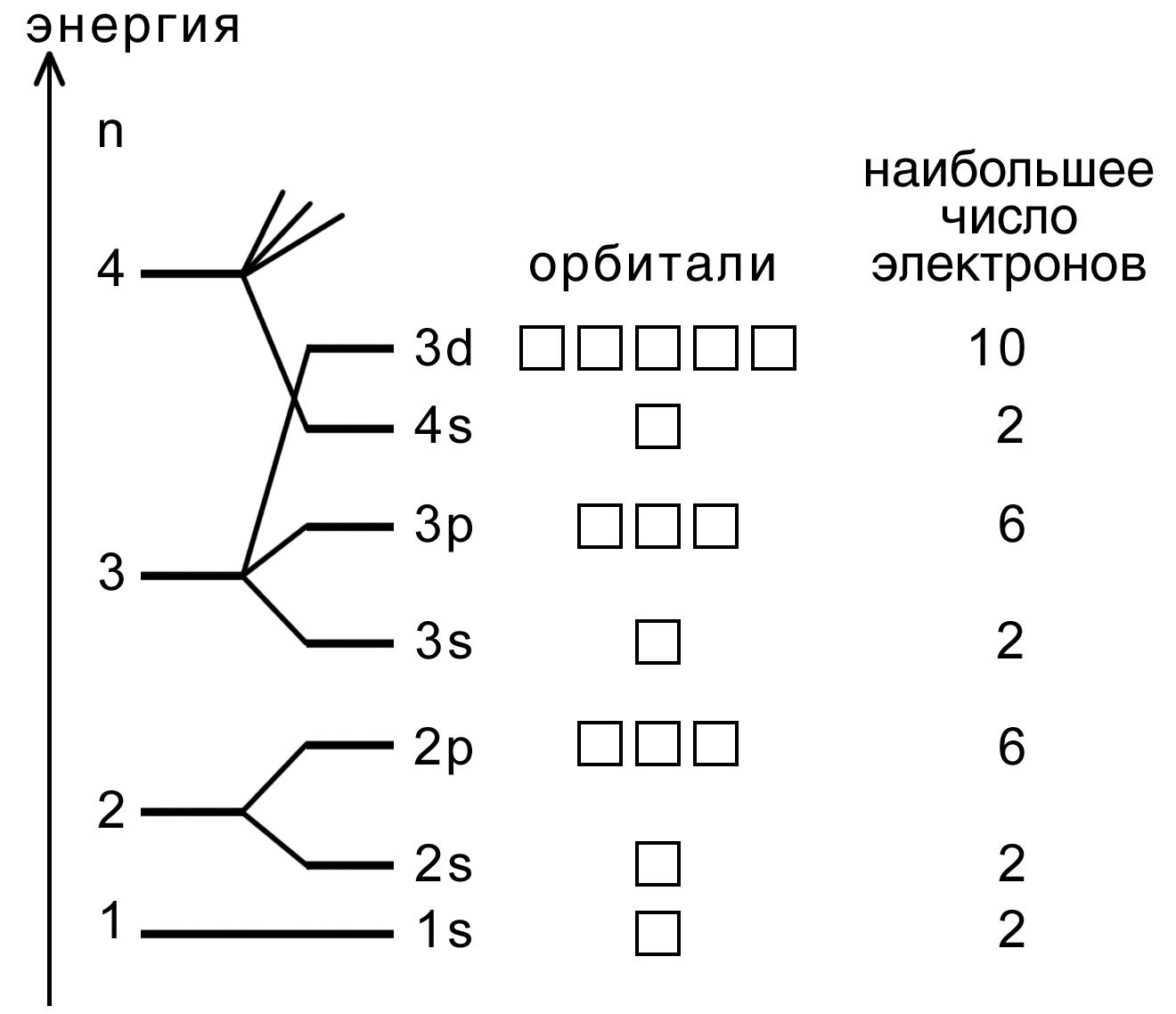
 Полностью завершенные энергетические уровни в химическом взаимодействии не участвуют. Правило гунда: в каждом подуровне электроны стремятся занять максимальное число свободных энергетических ячеек электронная формула - это графическое изображение распределения электронов по уровням и подуровням в атоме.
Полностью завершенные энергетические уровни в химическом взаимодействии не участвуют. Правило гунда: в каждом подуровне электроны стремятся занять максимальное число свободных энергетических ячеек электронная формула - это графическое изображение распределения электронов по уровням и подуровням в атоме.
 Орбиталей только в двух однотипных случаях: у атомов cr, cu, nb, mo, ru, rh, pd, ag, pt, au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более. Распределение электронов по энергетическим уровням.
Орбиталей только в двух однотипных случаях: у атомов cr, cu, nb, mo, ru, rh, pd, ag, pt, au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более. Распределение электронов по энергетическим уровням.
 Когда подуровню не хватает одного электрона до половинной или полной заполненности, заберите один электрон из ближайшего s или p- подуровня и переместите его на тот подуровень, которому необходим электрон. Электронные конфигурации записываются для того, чтобы четко отразить количество электронов на каждой орбитали. Существуют определенные правила, согласно которым происходит распределение электронов по подуровням и уровням.
Когда подуровню не хватает одного электрона до половинной или полной заполненности, заберите один электрон из ближайшего s или p- подуровня и переместите его на тот подуровень, которому необходим электрон. Электронные конфигурации записываются для того, чтобы четко отразить количество электронов на каждой орбитали. Существуют определенные правила, согласно которым происходит распределение электронов по подуровням и уровням.